Aplicações
A vanilina é um dos aromatizantes mais importantes, sendo largamente utilizado em alimentos, bebidas, perfumes e fármacos (Clark, 1990).
Existem várias espécies do gênero Vanilla, que crescem em locais diferentes e, consequentemente, produzem aromas que possuem leves variações. O aroma extraído da Vanilla fragrans é conhecido por possuir a melhor qualidade (Bourbon) para preparações alimentares como sorvetes, bolos, chocolates e bebidas. Os aromas extraídos da Vanilla tahitensis (Sul do Pacífico), Vanilla java (Indonésia) e Vanilla pompana (Antilhas) são utilizados em tabacos, sabonetes, perfumes e medicamentos (Almeida e Ferreira, 2008).
Aproximadamente 50% da produção mundial de vanilina sintética são usados como intermediário para síntese de herbicidas, agentes antiespumantes ou drogas tais como: papaverina, L-dopa, L-metildopa e agentes antimicrobianos (Figura 3). A vanilina também é utilizada para desodorizantes de ambientes e ceras para pisos e assoalhos (Almeida e Ferreira, 2008).
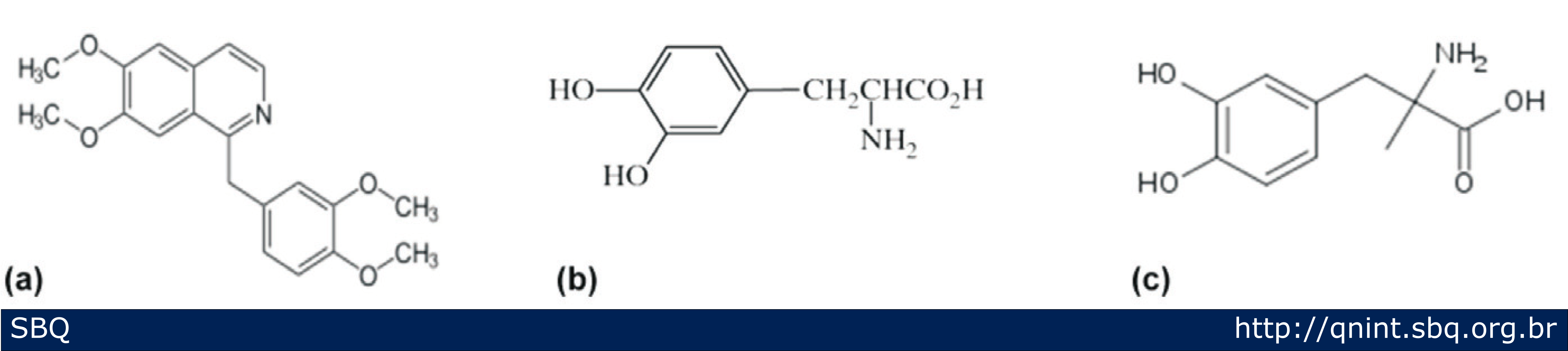
Figura 3: (a) Estrutura
A vanilina possui propriedades antimicrobianas e antioxidantes. O fato de o fenol e seus derivados possuírem ação antimicrobiana é conhecido desde 1800, quando o cirurgião Joseph Lister utilizou fenol para reduzir infecção em incisões cirúrgicas. O fenol e seus derivados lesam as células microbianas pela alteração da permeabilidade seletiva da membrana citoplasmática, causando uma perda das substâncias intracelulares vitais. Esses compostos também desnaturam proteínas como as enzimas (Pelczar e cols., 1997).
As propriedades antioxidantes da vanilina devem-se ao fato de esta interagir com espécies radicalares, evitando, dessa forma, os processos oxidativos (Angelo e Jorge, 2007).
Tais características justificam o amplo uso da vanilina em alimentos na condição de conservantes. Ainda assim, o efeito antimicrobiano da vanilina bem como de vários outros extratos vegetais ainda não é totalmente compreendido (Antoniolli e cols., 2004). Além disso, algumas pesquisas ilustram o seu potencial antimutagênico (Maurya e cols., 2007).
|
Produção da vanilina natural
A produção natural de vanilina é realizada por meio da colheita e maturação das vagens da orquídea. A vanilina encontra-se nas vagens sob a forma de gluco-vanilina, sendo que nessas condições não possui o aroma característico de baunilha. No entanto, após o processo de maturação que envolve a secagem e umificação das vagens e que pode durar até seis meses para ocorrer, a gluco-vanilina é hidrolizada enzimaticamente em glucose e vanilina (Figura 4). O conteúdo de vanilina extraído por esse processo é de aproximadamente 2,5% em massa (Hocking, 1997; Lampman e cols, 1977).
|
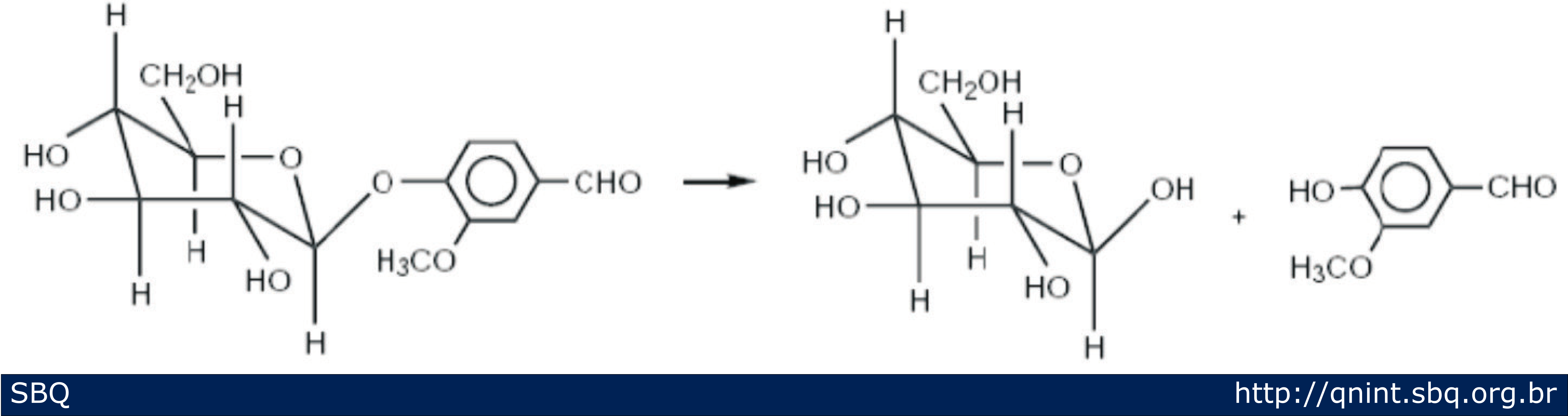
Figura 4: Esquema ilustrativo da hidrólise enzimática de gluco-vanilina em glucose e vanilina (Maurya e cols., 2007).
|
A vanilina natural também pode ser obtida mediante um processo de extração com etanol (60% v/v) em temperaturas brandas ou por meio da extração com fluidos quentes, em que as vagens são adicionadas sobre grades situadas em tanques de aço, nos quais o solvente é recirculado por um período de aproximadamente duas semanas (Greener Industry, 2008). A extração com etanol das vagens ainda é o processo mais vantajoso para a obtenção da vanilina (Hocking, 1997).
As pessoas que trabalham com a extração de vanilina podem ser acometidas por uma enfermidade denominada vanilismo (Almeida e Ferreira, 2008). Esta é uma doença ocupacional que se caracteriza por provocar erupções cutâneas, irritações na pele e na membrana da mucosa nasal, insônia, dor de cabeça, menstruação excessiva e irritação da bexiga (Kerber, 2005).
|
Produção da vanilina sintética
Teoricamente a vanilina sintética não possui diferença em relação à vanilina natural. Entretanto, na prática, existe diferença em relação ao cheiro e flavor. Essa evidência é relacionada ao fato de a vanilina natural ser o resultado de vários compostos extraídos que não existem na vanilina sintética (Mukhopadhyay, 2005).
Segundo Pacheco, Júnior e Morgado (2007):
“Os custos elevados, somados aos pequenos rendimentos da produção de vanilina natural, estimularam a pesquisa por rotas de produção de vanilina sintética. Dessa forma, em 1874-1875, menos de vinte anos após seu isolamento e caracterização, a molécula de vanilina foi sintetizada a partir do eugenol tornando-se disponível comercialmente na França e Estados Unidos por 176,00 dólares por quilo (Hocking, 1997). O eugenol (encontrado no óleo de cravo) [Figura 5] continuou a ser utilizado como material de partida para a síntese de vanilina até 1920”. (p. 46-47)
|
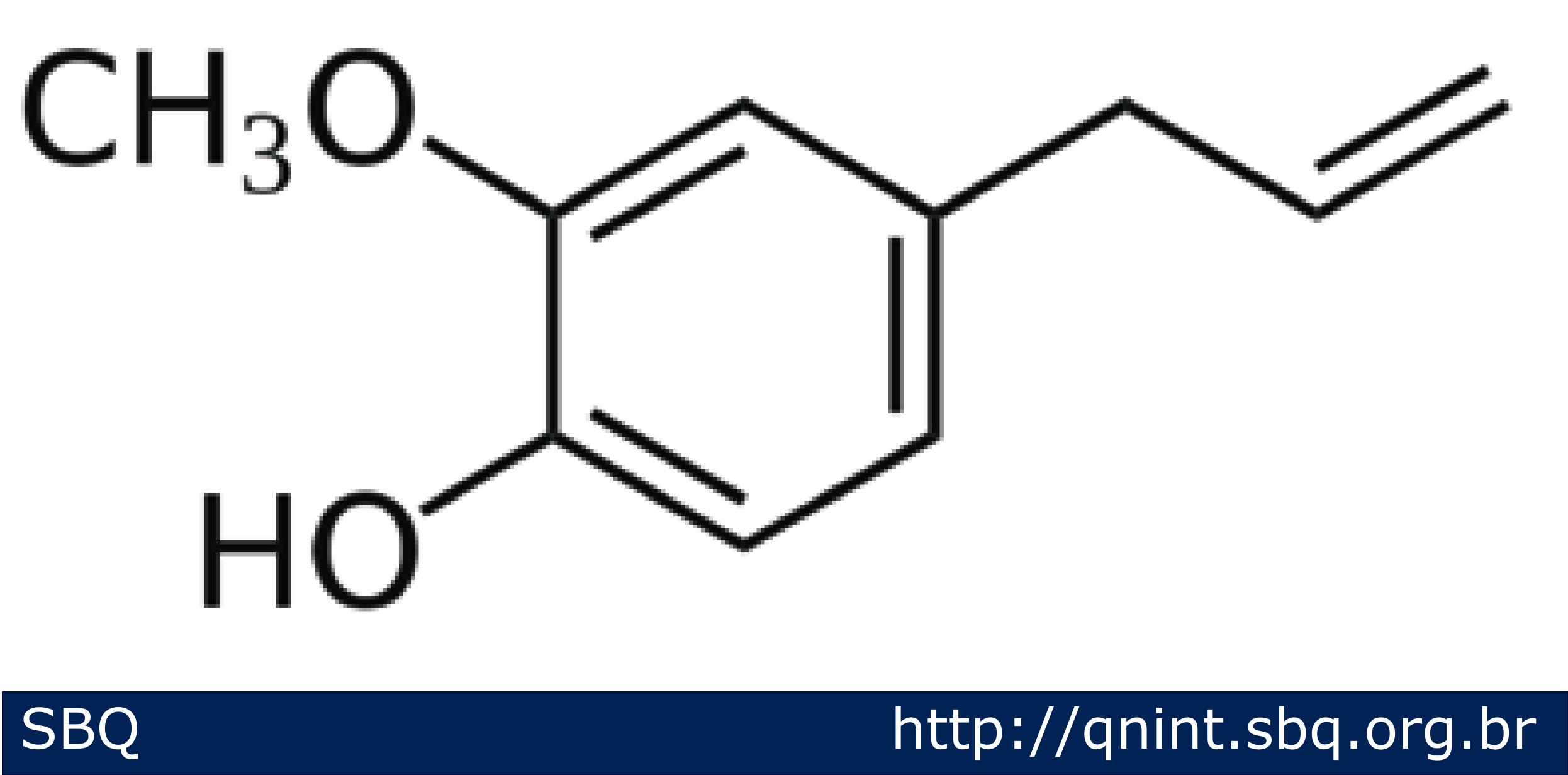
Figura 5: Estrutura química do eugenol.
Embora, a produção de vanilina por essa rota sintética possuir alto rendimento, esta consumia grandes quantidades de reagentes, o que desmotivou a produção da molécula por esse método. Mais tarde, a vanilina passou a ser sintetizada a partir da lignina contida no licor negro (Kortekaas e cols, 1998).
O licor negro é um resíduo das indústrias de papel e celulose que possui conteúdo de sólidos dissolvidos e uma grande diversidade de substâncias químicas oriundas da degradação de lignina (fenóis de baixa e alta massa molar e de toxicidade reconhecida) e polissacarídeos. A hipótese de que a vanilina poderia ser sintetizada a partir de substratos constituídos de lignina foi realizada por meio de uma publicação anônima em 1875 (Hocking, 1997).
A produção industrial de vanilina a partir da lignina contida no licor negro começou nos Estados Unidos em 1936 com a Salvo Chemical Corp. e a Marathon Paper Mills Co. de Wisconsin, utilizando a tecnologia desenvolvida por Tomlinson e Hibbert (Kortekaas e cols, 1998). Um ano depois, a Howard Smith Paper Mills Ltd. desenvolveu a primeira planta de produção de vanilina em grande escala no Canadá. Estudos realizados pela Ontario Pulp and Paper, em 1940, levaram à construção da segunda planta de produção de vanilina, chegando a uma produção de 227.000 Kg/ano em 1945 (Hocking, 1997).
Embora a produção de vanilina a partir do licor negro ter sido parcialmente motivada pelo interesse em reduzir o conteúdo de ligninas, açúcares e, consequentemente, a demanda bioquímica de oxigênio (DBO) desse rejeito, o processo possuía muitos inconvenientes como o fato de gerar um grande volume de resíduos tóxicos. Para produzir 1 kg de vanilina, eram utilizados 160 kg de líquidos cáusticos e gerados 150 kg de outras substâncias sem importância comercial e de reconhecido caráter tóxico (Hocking, 1997; Furukawa e cols., 1998; Greener Industry, 2008). Esse fator acabou levando ao fechamento das plantas no Canadá e nos EUA no fim da década de 1980 e início de 1990 (Hocking, 1997).
Atualmente, a maior parte da vanilina sintética é produzida por meio do uso de precursores derivados do petróleo. Os precursores oriundos da indústria petroquímica mais utilizados são o guaiacol e o p-cresol (Mukhopadhyay, 2005). Tais rotas vêm sendo mais usuais, pois elas são mais econômicas em relação às rotas que utilizam lignina e geram menos efluentes devido aos rendimentos das reações serem maiores (Hocking, 1997).
|
Produção da vanilina por meio de processos biotecnológicos
O aumento da população mundial impulsionou o crescimento de mercados especialmente voltados à produção de alimentos. Concomitante ao aumento do consumo de alimentos, encontra-se o aumento da demanda por aditivos alimentares, tais como a vanilina.
De acordo com o International Programs Center (U.S. Census Bureau), no mês de julho de 2010, estimou-se que a população mundial estava em mais de seis bilhões e oitocentas e cinquenta milhões de pessoas (Internacional Programs, 2010). Para suprir as necessidades da população, a inserção e o desenvolvimento de produtos sintéticos foram necessários devido ao fato de grande parte da superfície do planeta já ter sido ocupada pela agricultura. Apesar de os produtos sintéticos terem tornado-se imprescindíveis para o sustento da população mundial, existe um movimento crescente que impulsiona o consumo de produtos naturais (Furukawa e cols., 1998). Dessa forma, a vanilina sintética produzida de forma rentável e menos poluente por meio de precursores derivados do petróleo se confronta com o fato de utilizar compostos não renováveis para sua produção e, ainda, o de ser um produto sintético. Para contornar o dilema entre a grande demanda necessária dessa molécula e de se caracterizar como um produto sintético, a biotecnologia vem se mostrando como uma promissora solução.
Diversas publicações vêm demonstrando as formas de produção biotecnológica de vanilina. De acordo com Daugsch e Pastore (2005), quando essa molécula é produzida por meio de processos biotecnológicos, ela é considerada um produto natural, pois é oriunda de compostos de fontes renováveis e com custos relativamente baixos se comparados ao processo de extração da vanilina natural. Ainda segundo os autores citados, a produção biotecnológica da vanilina ocorre mediante o uso de extratos enzimáticos brutos ou enzimas purificadas produzidas principalmente por microrganismos ou plantas ou ainda por culturas de células.
Dentre os diversos compostos utilizados como precursores para a produção biotecnológica da vanilina, é possível citar a vanilil-amina, que pode ser extraída da pimenta. O estudo de Lesage-Meessen e cols. (1997) demonstrou que a vanilil-amina pode ser convertida em vanilina por meio da ação da enzima álcool vanililoxidase (EC 1.1.3.38).
Outra molécula que vem sendo intensamente estudada como precursora para a produção biotecnológica da vanilina é o ácido ferúlico que, por sua vez, é o componente majoritário da lignina. É válido ressaltar que a lignina, logo após a celulose, é a substância orgânica mais abundante da natureza. Dentro desse contexto, diversos fungos e bactérias capazes de biodegradar o ácido ferúlico vêm sendo isolados e estudados com o objetivo principal de se compreender os complexos mecanismos que envolvem a biodegradação da lignina e, consequentemente, a dos compostos fenólicos que a constituem. O ácido ferúlico também é encontrado em quantidades significativas na parede celular de exemplares importantes para a agricultura, tais como arroz, trigo, milho e beterraba (Narbad e Gasson, 1998).
Outros compostos fenólicos obtidos por meio de fontes naturais também podem ser utilizados para a produção biotecnológica de vanilina como, por exemplo, o ácido vanílico. O ácido vanílico também vem sendo citado em algumas publicações como composto intermediário formado antes da produção de vanilina a partir do ácido ferúlico. Alguns autores, tais como Lesage-Meessen e colaboradores (1996) e Stentelaire e colaboradores (2000), ilustraram a obtenção rentável de vanilina a partir de ácido vanílico, utilizando o fungo Pycnoporus cinnabarinus. Esse fungo não ocorre no hemisfério sul, porém é da mesma família que o Pycnoporus sanguineus, conhecido popularmente no Brasil como “orelha de pau” (Pacheco, Morgado e Furigo Júnior, 2008).
|
Considerações finais
Por meio do exposto anteriormente, foi possível observar que a vanilina é uma molécula de suma importância, estando presente sob várias formas em nosso cotidiano. Também foi possível vislumbrar os aspectos relacionados à sua origem e principalmente quanto às formas de produção, em que foi possível classificar a vanilina como natural ou sintética. Foi possível verificar que existe um grande campo a ser explorado no que tange à produção biotecnológica desse aroma, uma vez que as substâncias produzidas por esses processos são consideradas substâncias naturais.
|
Referências
ALMEIDA, A. e FERREIRA, M. Vanilina.
ANGELO, P.M. e JORGE, N. Compostos fenólicos em alimentos: Uma breve revisão. Revista Instituto Adolf Lutz, v. 66, p. 232-240, 2007.
ANTONIOLLI, L.R.; BENEDETTI, B.C.; SOUZA FILHO, M.S.M. e BORGES, M.F. Avaliação da vanilina como agente antimicrobiano em abacaxi ‘Pérola’ minimamente processado. Revista Ciência Tecnologia de Alimentos, v. 24, p. 473-477, 2004.
BYTHROW, J.D. Historical perspective Vanilla as a medicinal plant. Seminars in Integrative Medicine, v. 3, p. 129-131, 2005.
CLARK, G. S. Vanillin. Perfurmer Flavorist, v. 15, p. 45-54, 1990.
CLASSIC ENCYCLOPEDIA. Vanilla. 2006.
COURTEUR, P. L. e BURRESON, J. Os botões de Napoleão. As 17 moléculas que mudaram a história. Rio de Janeiro: Jorge Zahar, 2006.
DAUGSCH, A. e PASTORE, G. Obtenção de vanilina: oportunidade biotecnológica. Química Nova, v. 28, p. 642-645, 2005.
FURUKAWA, H.; WIESER M.; MORITA, H.; SUGIO, T. e NAGASAWA, T. Purification and characterization of eugenol dehydrogenase from Pseudomonas fluorescens E118. Archives Microbiology, v. 171, p. 37-43, 1998.
GREENER INDUSTRY. Production methods summary.
HOCKING, M.B. Vanillin: synthetic flavoring from spent sulfite liquor. Journal of Chemical Education, n. 74, p. 1055-1059, 1997.
KERBER, K. L. Sexual selection in man. New Delhi: Global Vision, 2005.
KORTEKAAS. S.; VIDAL, G.; YAN-LING, H.; LETTINGA, G. e FIELD, J.A. Anaerobic-aerobic treatment of toxic pulping black liquor with upfront effluent recirculation. Journal Fermentation Bioengineering, v. 86, p. 97-110, 1998.
LAMPMAN, G.M.; ANDREWS, J.; BRATZ, W.; HANSSEN, O.; KELLEY, K.; PERRY, D.A. e RIDGEWAY, A. Preparation of vanillin from eugenol and sawdust. Journal of Chemical Education, n. 54, p. 776-778, 1977.
LESAGE-MEESSEN, L.; DELATTRE, M.; HAON, M.; THIBAULT, J.F.; COLONNA, C.B.; BRUNERIE, P. e ASTHER, M. A two-step bioconversion process for vanillin production from ferulic acid combining Aspergillus niger and Pycnoporus cinnabarinus. Journal of Biotechnology, v. 50, p. 107-113, 1996.
LESAGE-MEESSEN, L.; HAON, M.; DELATTRE, M.; THIBAULT, J.F.; CECCALDI, C. e ASTHER, M. An attempt to channel the transformation of vanillic acid into vanillin by controlling methoxyhydroquinone formation in Pycnoporus cinnabarinus with cellobiose. Applied Microbiology and Biotechnology, n. 4, p. 393-397, 1997.
LOMASCOLO, A.; STENLELAIRE, C.; ASTHER, M. e LESAGE-MEESSEN, L. Basidiomycetes as new biotechnological tools to generate natural aromatic flavours for the food industry. Trends in Biotechnology, v. 17, p. 282-289, 1999.
MAURYA, D.K.; ADHIKARI, S.; NAIR, C.K.K. e DEVASAGAYAN, T.P.A. DNA protective properties of vanillin against γ-radiation under different conditions: possible mechanisms. Mutation Research Genetic Toxicology and Environmental Mutagenesis, n. 643, p. 69-80, 2007.
MEC/SEMTEC - Ministério da Educação/ Secretaria de Educação Média e Tecnológica. PCN+: Orientações educacionais complementares aos Parâmetros Curriculares Nacionais - Ciências da Natureza, Matemática e suas tecnologias. Brasília: MEC/SEMTec, 2002.
MUKHOPADHYAY, A. K. Industrial chemical cresols and downstream derivateds. New York: CRC, 2005.
NARBAD, A. e GASSON, M. Metabolism of ferulic acid via vanillin using a novel CoA-dependent pathway in a newly-isolated strain of Pseudomonas fluorescens. Microbiology, n. 144, p. 1397-1405, 1998.
ORTOBOTANICO. Serre delle piante utili.
INTERNACIONAL PROGRAMS. World Pop Clock Projection.
PACHECO, S.M.V.; MORGADO, A.F. e FURIGO JÚNIOR, A. Biossíntese de vanilina por três isolados de Pycnoporus sanguineus. In: CONGRESSO BRASILEIRO DE ENGENHARIA QUÍMICA, 17, 2008, Recife. CD Anais COBEQ 2008. Recife, 2008.
PELCZAR, M.J.; CHAN, E.C.S. e KRIEG, N.R. Microbiologia. Conceito e aplicações. v. 1. 2 ed. São Paulo: Pearson Makron, 1997.
|




Nenhum comentário:
Postar um comentário